درون جنین میلیونها سلول بنیادی وجود دارد که بزرگی همه آنها کمتر از یک نقطه است. این سلولها از پتانسیل بالایی برخوردار هستند و میتوانند طی فرایند تمایز یابی به سلولهای بافتهای مختلف در بدن تبدیل شوند. پتانسیل تقریبا نامحدود این سلولها آنها را در کانون تحقیقات پزشکی قرار داده است. تصور کنید که این سلولها بتوانند حافظه بیمار مبتلا به آلزایمر را به وی برگردانند.
پوستی را که در اثر سانحه آسیب دیده جایگزین کنند یا بیمار معلولی را قادر به راه رفتن دوباره کنند! و. اما پیش از آنکه دانشمندان نحوه استفاده از سلولهای بنیادی را برای مقاصد پزشکی فرا بگیرند باید دریابند که چگونه میتوانند قدرت این سلولها را تحت کنترل خود درآورند. آنها باید نحوه استفاده از سلولهای بنیادی و تبدیل آنها به بافتها یا اندامهای خاصی را فرا بگیرند تا بتوانند یک بیمار یا بیماری علاج کنند.
سلول بنیادی چیست؟
سلول بنیادی سازنده بدن انسان است. سلولهای بنیادی درون جنین در نهایت به سلول، بافت و اندامهای مختلف بدن جنین تبدیل میشوند. برخلاف یک سلول معمولی که قادر است با تکثیر شدن چندین سلول از نوع خود را بوجود آورد سلول بنیادی همه منظوره و بسیار توانمند است و وقتی تقسیم شود، میتواند به هر یک از انواع سلولها در بدن تبدیل شود. سلولهای بنیادی از قابلیت خود نوسازی هم برخوردارند. سلولهای بنیادی خود بر دو نوع هستند. سلولهای بنیادی جنینی و سلولهای بنیادی بالغ.
سلولهای بنیادی جنینی از جنین بدست میآیند. یک جنین 3 تا 5 روزه حاوی سلولهای بنیادی است که به شدت در حال تکثیر هستند تا اندامها و بافتهای مختلف جنین را بسازند. افراد بالغ نیز در قلب، مغز، مغز استخوان ، ریه ها و اندامهای دیگر خود سلولهای بنیادی دارند. این سلولها مجموعههای درونی مخصوص ترمیم هستند و سلولهایی که بر اثر بیماری، مصدومیت و کهولت سن صدمه میبینند دوباره تولید میکنند.
تاریخچه
در اوایل دهه 1980 میلادی دانشمندان نحوه قرار گرفتن سلولهای بنیادی جنینی از موش و کشت آنها را در آزمایشگاه فرا گرفتند و در سال 1998 برای اولین بار در سلولهای بنیادی جنینی انسان را در آزمایشگاه تولید کردند. اما این سوال پیش میآید که پژوهشگران جنین انسان را از کجا بدست میآورند؟ جنین را میتوان با تولید مثل، تلفیق اسپرم و تتخمک یا شبیه سازی تولید کرد.
راههای تولید جنین
تولید مثل
این راه طبیعی تولید جنین است.
تلفیق گامتها در شرایط آزمایشگاه
پژوهشگران تمایل زیادی به تولید جنین از طریق تلفیق اسپرم و تخمک ندارند. با این وجود بسیاری از آنها جنینهای بارور شده در کلینیکهای بارورسازی استفاده میکنند. گاهی اوقات زوجهایی که نمیتوانند بطور طبیعی بچهدار شوند و میخواهند به شیوه مصنوعی صاحب فرزند شوند چندین جنین بارور شده تولید میکنند که همگی آنها مورد استفاده قرار نمیگیرند. و جنینهای اضافی را برای انجام تحقیقات علمی اهدا کنند.
شبیه سازی درمانی
در این شیوه یک سلول از بیماری که نیازمند درمان از طریق سلول بنیادی است با تخمک اهدا شده ادغام میشود. پس از آن هسته تخمک جدا شده و هسته سلول شخص بیمار جایگزین آن میگردد. سپس تخمک حاصل از طریق شیمیایی یا الکتریکی تحریک میگردد تا تقسیم سلولی انجام دهد. جنین حاصل مواد ژنتیکی بیمار را حمل خواهد کرد که میتواند پس زدن سلولهای بنیادی را پس از پیوند آنها به میزان زیادی کاهش دهد.
تکثیر سلولهای بنیادی در آزمایشگاه
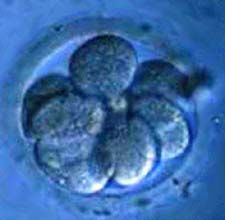
جنین 3 تا 5 روزه را بلاستوسیست مینامند. یک بلاستوسیست توده ای مشکل از 100 سلول و یا بیشتر است. سلولهای بنیادی سلولهای درونی بلاستوسیست هستند که در نهایت به هر سلول، بافت و اندام درون بدن تبدیل میشوند. دانشمندان سلولهای بنیادی را از بلاستوسیست جدا کرده و آنها را درون ظرف پتری دیش در آزمایشگاه کشت میدهند. پس از آنکه سلولها چندین بار تکثیر شدند و میزان آنها از گنجایش ظرف کشت فراتر رفت آنها را از آن ظرف برداشته و درون چندین ظرف قرار میدهند. سلولهای بنیادی جنینی که چندین ماه بدون ایجاد تمایز پرورش یافتهاند خط سلول بنیادی نامیده میشوند.
این خطوط سلولی را میتوان منجمد کرده و بین آزمایشگاهها به اشتراک گذاشت. کار با سلولهای بنیادی بالغ برای دانشمندان سختتر است. زیرا استخراج و کشت آنها نسبت به سلولهای بنیادی جنینی دشوارتر است. یافتن سلولهای بنیادی در بافت بالغ به تنها مشکل است بلکه دانشمندان هم برای کنترل آنها در آزمایشگاه با مشکل رو به رو هستند. اما حتی کنترل سلولهای بنیادی جنینی هم که به خوبی در آزمایشگاه پرورش مییابند آسان نیست دانشمندان همچنان در تلاشند تا این سلولها را به رشد در انواع خاصی از بافت وادارند.
موانع بر سر راه استفاده از سلول بنیادی
یکی از این موانع مشکل پس زدن است. اگر سلولهای بنیادی جنینی اهدا شده به یک بیمار تزریق شوند ممکن است سیستم ایمنی بدن بیمار این سلولها را مهاجمان خارجی تلقی کرده و به آنها حمله کند. اما استفاده از سلولهای بنیادی بالغ تا حدودی از این مشکل میکاهد. زیرا سیستم ایمنی بدن بیمار سلولهای بنیادی خود بیمار را پس نمیزند.
کاربرد سلولهای بنیادی در بازسازی سلولها
از سلولهای بنیادی میتوان برای بازسازی سلولها یا بافتهایی استفاده کرد که بر اثر بیماری یا جراحت صدمه دیدهاند. این نوع درمان به درمان سلولی معروف است. یکی از کاربردهای بالقوه این شیوه درمان، تزریق سلولهای بنیادی جنینی در قلب برای بازسازی سلولهایی است که بر اثر حمله قلبی صدمه دیدهاند. در یکی از تحقیقات، پژوهشگران زمینه سکته قلبی چندین موش را فراهم کرده و پس از آن سلولهای بنیادی جنینی را درون قلب آسیب دیده موشها تزریق نمودند. در نهایت سلولهای بنیادی بافت ماهیچه آسیب دیده را بازسازی کردند و کارکرد قلب موشها را بهبود بخشیدند.
از سلولهای بنیادی میتوان برای بازسازی سلولهای مغزی بیماران مبتلا به پارکینسون استفاده کرد. این بیماران فاقد سلولهایی هستند که ناقل عصبی موسوم به دوپامین را تولید میکنند. بدون وجود این پیک شیمیایی حرکت بیماران مبتلا به پارکینسون نامنظم و منقطع است. و این افراد از ارزشهای غیر قابل کنترل رنج میبرند. در تحقیقات انجام شده روی موشها پژوهشگران سلولهای بنیادی جنینی را در مغز موشهای مبتلا به بیماری پارکینسون تزریق کردند و شاهد آن بودند که سلولهای بنیادی، موشها را بهبود بخشیدند. دانشمندان امیدوارند که روزی بتوانند این موفقیت خود را در انسانهای مبتلا به پارکینسون هم تکرار کنند.
کاربرد سلولهای بنیادی در تولید اندام کامل
شاید دانشمندان بتوانند حتی یک اندام کامل را در آزمایشگاه پرورش داده و آن را جایگزین اندامی کنند که بر اثر بیماری آسیب دیده است. برای این کار باید نوعی چارچوب از جنس پلیمر زیست تجزیه پذیر را به شکل اندام مورد نظر بسازند و سپس آن را با سلولهای بنیادی جنینی یا بالغ بارور سازند. پس از آن عوامل رشد مخصوص آن اندام افزوده میشوند تا پرورش اندام را تحت کنترل و هدایت درآورند.
پس از آنکه چارچوب با بافت خاص آن اندام پوشیده شد آن را به بیمار پیوند میزنند. با بوجود آمدن بافت از سلولهای بنیادی چارچوب تجزیه شده و در نهایت یک گوش، کبد یا هر اندام دیگر باقی خواهد ماند. از جمله بیماریهایی که احتمالا روزی یا درمان سلولی معالجه خواهند شد میتوان به پارکینسون، دیابت، بیماری قلبی، صدمه به نخاع، سوختگی، آلزایمر و ضعف بینایی اشاره کرد.
اختلاف نظر در مورد تحقیقات سلول بنیادی
تحقیقات سلول بنیادی یکی از بزرگترین موضوعاتی است که اجتماعات علمی و مذهبی را رو در رو قرار داده است و هسته این اختلاف یک سوال است حیات چه موقع آغاز میشود؟ برای بدست آوردن سلولهای بنیادی دانشمندان یا باید از جنینی استفاده کنند که بارور شده است و یا به روش شبیه سازی، جنینی را از سلول بدن بیمار و تخمک اهدایی بسازند. در هر دو صورت برای جدا کردن سلولهای بنیادی یک جنین باید جنین از بین برود. و اگرچه این جنین تنها 4 یا 5 سلول را دربرمیگیرد. بعضی از رهبران مذهبی بر این باورند که این کار همانند گرفتن جان یک انسان است.
شبیه سازی انسان
مساله دیگر مورد اختلاف شبیه سازی انسان است. اگر دانشمندان بتوانند جنینی را در آزمایشگاه خلق کنند آیا نمیتوانند آن جنین را درون رحم یک مادر دیگر پیوند زده و زمینه رشد یک نوزاد را فراهم کنند؟! ایده شبیه سازی انسان افکار هولناک و مخوف پرورش ابر انسانها با ضریب هوشی بسیار بالا و قابلیتهای فیزیکی مانند قهرمانان خیالی سوپر من و بت من و یا خلق کودکانی که صرفا برای استفاده از اندام پرورش مییابند را تداعی میکند. هنگامی که گروهی از محققان اسکاتلندی در سال 1997 اعلان کردند که توانستهاند با موفقیت گوسفندی را به نام دالی شبیه سازی کنند وحشت ناشی از شبیه سازی شدت گرفت. حتی با افزایش آگاهی و شناخت دانشمندان از سلولهای بنیادی و توانایی کنترل آنها بحثهای اخلاقی و سیاسی در این مورد داغتر و وخیمتر میشود. بسیاری از دولتها محدودیتهای شدیدی را بر تحقیقات سلول بنیادی اعمال کردهاند و تامین بودجه این تحقیقات را با مشکلات زیادی مواجه نمودهاند.
آینده بحث
مخالفت جامعه جهانی با پدیده شبیه سازی مولد انسان گسترده و عامالشمول است. اما به نظر میرسد بسیاری از کشورها با انجام تحقیقات پزشکی برای مقابله با بیماریهایی چون پارکینسون،آلزایمر، بیماری های قلبیو سرطانازطریق تولید جنینهای آزمایشگاهی و همچنین تحقیق و بررسی روی آنها به منظور ایجاد توسعه و پیشرفت در علوم پزشکیو مهندسی ژنتیک بدون آن که هدف این تحقیقات تولد صرف انسان شبیه سازی شده باشد، مخالفت چندانی نداشته باشند. با وجود این، برخی کشورها از جمله واتیکان مخالفت صریح و موکد خود را در این مورد ابراز داشته و با عمل شبیه سازی انسان با هر هدف و مقصودی که باشد، مخالفند.
از جمله استدلالهای این گروه برای مخالفت با شبیه سازی این است که ما با این کار به تولید انسانهایی اقدام میکنیم که در نهایت آنها را از میان میبریم و از اینرو، در جهتی حرکت خواهیم کرد که منجر به نقض قواعد اساسی حقوق بشر و کرامت انسانی خواهد شد. آیا اصولا ما حق داریم که با انسان زنده آزمایشهای علمی بکنیم. بعضیها میگویند که اینکار به بشریت خدمت خواهد کرد ممکن است این گفته درست باشد ولی آیا شما حاضرید خود حاصل چنین تولدی باشید و محکوم به تولد برای آزمایش و ابزار آزمایش دانشمندان باشید؟
منبع: تارنگار دانشجویان گروه زیست شناسی دانشکده علوم دانشگاه فردوسی